医薬品の市販前において未知のリスクがないことを完全に保証することはできない。医薬品のライフサイクルにわたる安全性監視が必要とされるが、欧米と比べて日本には欠けている大きなものがある。それは、利用可能な大規模データベースである。
欧米諸国では定量的評価を可能にする大規模なデータベースが構築されて、自発報告などからの医薬品に関する安全性仮説の検証などのための情報基盤として重要な役割を果たしている。国際薬剤疫学会のホームページには60を超えるデータベースが公表されている。例えば、米国の5千万人を超えるMedicaid受給者、カナダSaskatchewan 州の全住民(100万人超)の保険請求データベースなどがある。より精度の高い豊富な情報を含む医療記録に基づくものとしては、数十万人から数百万人規模の米国のHealth Maintenance Organization のデータベース、英国の300万人超のGeneral Practice Research Databaseなどがある。

- 藤田 利治
- リクス解析戦略研究センター
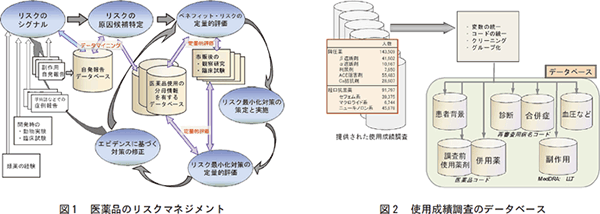
これまでの医薬品の安全対策は、副作用の症例報告の収集・評価・伝達といったドラッグ・モニタリングの考え方が中心であった。しかしながら、これでは十分に医薬品のリスクに対処できない事態が発生することが多くなった。医薬品にかかわる規制の最近の焦点は、リスクの早期同定とリスクマネジメントに集中している。図1には医薬品のリスクマネジメントの概要を示したが、大規模データベースの存在が前提となっている。
リスク解析戦略研究センターでは、医薬品の安全確保のためのデータベースが欠如している日本の状況を打開すべく、2種類のデータベース構築を進めている。
ひとつは、市販前の臨床試験のデータベース化である。コントローラー委員会が管理を行った約900臨床試験のデータの提供を受け、まず降圧薬の臨床試験のデータベース構築に着手した。臨床試験データベースに基づいて、個人データでのメタアナリシスによる開発段階での有効性/安全性の問題の検討が可能となり、また、臨床試験デザインや薬効評価の統計的手法の開発に実データを用いた研究を行うことができる。
もうひとつは、市販後の医薬品の使用成績調査のデータベースである。くすりの適正使用協議会とともに実施しているものであるが、14万症例超の降圧薬データベースと9万症例超の経口抗菌薬データベースが利用可能な状況になっている(図2)。この使用成績調査データベースに基づいて、解析対象集団を適切に設定した研究デザインによる検討も実施できる。既に、非ステロイド性消炎鎮痛薬の併用による降圧薬の降圧効果の減弱を検証したコホート研究や、降圧薬のACE 阻害剤による空咳のリスク要因を探索したケース・コントロール研究を報告している。また、対照群を置かない特定の使用成績調査に対して、症例特性等をマッチさせた適切な既存対照を設定することも可能であり、特定の医薬品の相対的評価に役立てることができる。
こうしたデータベースの構築を通して、医薬品の有効性・安全性のシグナル検出および定量的評価の統計的手法の研究・開発をも促進し、医薬品の安全確保の推進に結び付けたいと考えている。